Organické sloučeniny gallia

Organické sloučeniny gallia jsou organokovové sloučeniny obsahující vazby mezi atomy uhlíku a gallia. I přes vysokou toxicitu se tyto sloučeniny používají v organické syntéze. Trimethylgallium má využití v MOCVD jako prekurzor pro výrobu nitridu gallitého[1], či arsenidu gallitého, který zde vzniká reakcí s arsanem při 700 °C:
- Ga(CH3)3 + AsH3 → GaAs + 3CH4
K zavádění gallia do organických sloučenin se často používá chlorid gallitý.
Hlavním oxidačním číslem gallia je III, podobně jako u dalších lehčích prvků 13. skupiny, jako je hliník.[2][3]
Organogallité sloučeniny
Sloučeniny s obecným vzorcem R3Ga jsou monomerní. Lewisovská kyselost se snižuje v řadě Al > Ga > In a organogallité sloučeniny tak nevytváří dimery jako sloučeniny organohlinité; také jsou méně reaktivní. Vytvářejí stabilní peroxidy.[4]
Organogallité sloučeniny mohou být připraveny transmetalací, například z kovového gallia a dimethylrtuti:
- 2Ga + 3Me2Hg → 2Me3Ga + 3 Hg
nebo z organolithných sloučenin či Grignardových činidel:
- GaCl3 + 3MeMgBr → Me3Ga + 3MgBrCl
Povahu gallia vyznačující se nedostatkem elektronů lze změnit tvorbou komplexů, například:
- Me2GaCl + NH3 → [Me2Ga(NH3)Cl]+Cl−
Je také popsána tvorba pí komplexů s alkyny.
Organogallíté sloučeniny jsou reaktanty nebo meziprodukty při několika druzích organických reakcí:
- Barbierovy reakce gallia, allylových substrátů a karbonylových sloučenin
- Karbometalace (konkrétně karbogallace)[5]
Organické sloučeniny těžších prvků 13. skupiny
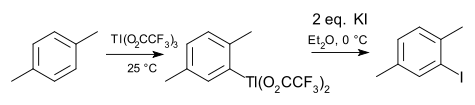
Organické sloučeniny india a thallia mají vlastnosti v mnohém podobné odpovídajícím sloučeninám gallia. Indium a thallium se v oxidačním čísle I vyskytují častěji než gallium, vytvářejí například cyklopentadienylindný a cyklopentadienylthallný kation. Trimethylindium má využití v polovodičovém průmyslu. Zvláštní vlastností thallia jsou elektrofilní thallace na areny, podobné merkuracím (rtuť je sousedním prvkem 12. skupiny), při těchto reakcích se často používá trifluoroctan thallitý. Arylbisfluoroctan thallitý vznikající jako meziprodukt lze izolovat a přeměnit na arylhalogenid, arylkyanid, arylthiol nebo nitroaren; příkladem může být jodace p-xylenu.[6]
Reference
V tomto článku byl použit překlad textu z článku Organogallium chemistry na anglické Wikipedii.
- ↑ LAM, H. -T.; VOHS, J. M. Surface reactions of trimethylgallium on MOVPE-grown GaN(0001). Surface Science. 1999-05-10, roč. 426, čís. 2, s. 199–211. Dostupné online [cit. 2022-11-22]. ISSN 0039-6028. DOI 10.1016/S0039-6028(99)00291-5. (anglicky)
- ↑ C. Elschenbroich, A. Salzer Organometallics : A Concise Introduction (2nd Ed) (1992) from Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ↑ Chemistry of aluminium, gallium, indium, and thallium Anthony John Downs (Ed.) ISBN 978-0-7514-0103-5, 1993
- ↑ W. Uhl, M. R. Halvagar et al. Reducing Ga-H and Ga-C Bonds in Close Proximity to Oxidizing Peroxo Groups: Conflicting Properties in Single Molecules. Chemistry: A European Journal. 2009, s. 11298–11306. DOI 10.1002/chem.200900746. PMID 19780106.
- ↑ Amemiya Ryo; Yamaguchi Masahiko. GaCl3 in Organic Synthesis. European Journal of Organic Chemistry. 2005, s. 5145–5150. DOI 10.1002/ejoc.200500512.
- ↑ 2-IODO-p-XYLENE. Organic Syntheses. 1976, roč. 55, s. 70. Dostupné online [cit. 2024-02-09]. DOI 10.15227/orgsyn.055.0070.
| Organické sloučeniny s vazbami uhlíku na ostatní prvky | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Legenda, chemické vazby s uhlíkem: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||