塩化ウラン(III)
| 塩化ウラン(III) | |
|---|---|
 | |
Uranium(III) chloride | |
別称 塩化ウラン (Uranium chloride) 三塩化ウラン (Uranium trichloride) Hypouranous chloride | |
| 識別情報 | |
| CAS登録番号 | 10025-93-1 |
| PubChem | 167444 |
| ChemSpider | 146484  |
| |
| |
| 特性 | |
| 化学式 | Cl3U |
| モル質量 | 344.39 g mol−1 |
| 外観 | 緑色結晶性固体 |
| 密度 | 5.500 g/cm3(溶融状態) |
| 融点 | 837 °C, 1110 K, 1539 °F |
| 沸点 | 1657 °C, 1930 K, 3015 °F |
| 水への溶解度 | 可溶 |
| 構造 | |
| 結晶構造 | 三冠三角錐構造 |
| 危険性 | |
| 引火点 | 不燃性 |
| 発火点 | 不燃性 |
| 関連する物質 | |
| 関連物質 | 塩化ウラン(IV), 塩化ウラン(V), 塩化ウラン(VI) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化ウラン(III) (UCl3) はウランと塩素の化合物である。主に使用済み核燃料の再処理に用いられる。塩化ウラン(IV)からさまざまな方法で合成されるが、塩化ウラン(IV)よりも不安定である。
生成
塩化ウラン(III)の生成法としては以下の二つが知られている。
性質
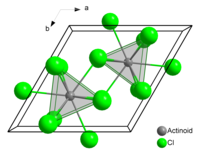
塩化ウラン(III)の結晶ではウラン原子の周りを9つの塩素原子がほぼ等間隔で囲んでおり、 三冠三角錐構造(tricapped trigonal prismatic configuration, TTP)をとる[3]
塩化ウラン(III)は室温では緑色の結晶性固体である。融点 837 ℃、沸点 1657 ℃で密度は 5.500 g/cm3 である。
塩化ウラン(III)は水に非常によく溶け吸湿性が高い。塩酸に溶解させると安定する。[4]
用途
試薬
塩化ウラン(III)はテトラヒドロフランとメチルシクロペンタジエンとともにウランのメタロセン複合体の誘導に用いられる[5]
触媒
塩化ウラン(III)は水素化アルミニウムリチウム (LiAlH4) とアルケンからアルミン酸アルキル化合物を得る際の触媒として用いられる[6]。
溶融塩
塩化ウラン(III)の溶融塩は使用済み核燃料の再処理における熱化学的な処理で重用され[7]、主に使用済み核燃料から電解精錬法によりウランを抽出するのに用いられている[7][8]。
水和物
塩化ウラン(III)の水和物は以下の3種が知られている。
いずれも適量の水とプロピオン酸の存在下でアセトニトリル中で塩化ウラン(IV)を還元すると生じる[9]。
危険性
塩化ウラン(III)の長期毒性については十分知られていないため、塩化ウラン(III)への曝露は必要最小限にすることが重要である。
塩化ウラン(III)は腎毒性を持ち[10]、他の可溶性ウラン化合物と同様に、肺胞から血中に取り込まれる。
脚注
- ^ Serrano, K.; Taxil, P.; Dugne, O.; Bouvet, S.; Puech, E. J. Nucl. Mater. 2000, 282, 137–145.
- ^ Remsen, Ira. Inorganic Chemistry. New York: Henry Holt and Company, 1890.
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ Comey, Arthur M.; Hahn, Dorothy A. A Dictionary of Chemical Solubilities: Inorganic. New York: The MacMillan Company, 1921.
- ^ Brenna, J.G.; Anderson, R.A.; Zalkin, A. Inorg. Chem. 1986, 25, 1756–1760.
- ^ Le Marechal, J.F.; Ephritikhine, M.; Folcher, G. J. Organomet. Chem. 1986, 309, C1–C3.
- ^ a b Okamoto, Y.; Madden, P.; Minato, K. J. Nucl. Mater. 2005, 344, 109–114.
- ^ Okamoto, Y.; Kobayashi, F.; Ogawa, T. J. Alloys Compd. 1998, 271, 355–358.
- ^ Mech, A.; Karbowick, M.; Lis, T. Polyhedron. 2006, 25, 2083–2092.
- ^ Bertell, Rosalie. "Gulf War Veterans and Depleted Uranium." May 1999. Available: http://ccnr.org/du_hague.html
外部リンク
- Uranium(III) chloride information at Webelements
- Uranium(III) chloride International Bio-Analytical Industries, Inc.
| |||
|---|---|---|---|
| U(II) |
| ||
| U(III) |
| ||
| U(IV) |
| ||
| U(IV,V) |
| ||
| U(V) |
| ||
| U(V,VI) |
| ||
| U(VI) |
| ||
| |||












