Triazane
| Triazane | |
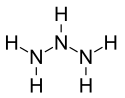 | |
| Structure du triazane | |
| Identification | |
|---|---|
| No CAS | 14451-01-5 |
| PubChem | 446953 |
| ChEBI | 50155 |
| SMILES | NNN PubChem, vue 3D |
| InChI | Std. InChI : vue 3D InChI=1S/H5N3/c1-3-2/h3H,1-2H2 Std. InChIKey : PYHOFAHZHOBVGV-UHFFFAOYSA-N |
| Propriétés chimiques | |
| Formule | H5N3N3H5 |
| Masse molaire[1] | 47,059 8 ± 0,001 g/mol H 10,71 %, N 89,29 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier  | |
Le triazane est un composé chimique de formule H2N–NH–NH2[2]. C'est le troisième élément de la série homologue des azanes acycliques NnHn+2, après l'ammoniac NH3 et l'hydrazine N2H4.
On peut obtenir du triazane en faisant réagir de l'ammoniac dans une zéolithe avec un revêtement d'argent[3]. Il peut également être obtenu sous forme de chlorhydrate en faisant réagir l'hydrazine avec de la chloramine NH2Cl dans l'éther éthylique ; ce produit est cependant instable et se désintègre immédiatement[4].
- N2H4 + NH2Cl ⟶ N3H5⋅HCl.
Il n'est en pratique possible d'isoler que des sels de triazane comme le sulfate de triazanium [N3H83+]2[SO42−]3 et non la forme basique libre. Les tentatives pour convertir des sels de triazanium en base libre n'aboutissent qu'à la formation d'ammoniac NH3 et de diimide HN=NH[5].
Du triazane peut être produit par irradiation électronique de glace d'ammoniac et être ensuite détecté comme produit gazeux stable après sublimation[6].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) « Triazane », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- ↑ (en) Reinhard Haubold, Claudia Heinrich-Sterzel, Ulrike Ohms-Bredeman, Carol Strametz, Gmelin Handbook of Inorganic and Organometallic Chemistry, N. Springer Science & Business Media, 1993, p. 167. (ISBN 3-662-06336-0)
- ↑ (de) A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie, 101e éd., Walter de Gruyter, Berlin 1995, p. 669–670. (ISBN 3-11-012641-9)
- ↑ (en) Nils Wiberg, A. F. Holleman et Egon Wiberg, Holleman-Wiberg's Inorganic Chemistry, 1re éd., Academic Press, 2001, p. 627. (ISBN 978-0-12-352651-9)
- ↑ (en) Marko Förstel, Pavlo Maksyutenko, Brant M Jones, Bing-Jian Sun, Shih-Hua Chen, Agnes H.-H. Chang et Ralf I. Kaiser, « Detection of the Elusive Triazane Molecule (N3H5) in the Gas Phase », Chemphyschem, vol. 16, no 15, , p. 3139-3142 (PMID 26331382, DOI 10.1002/cphc.201500560, lire en ligne)
v · m | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hydrures alcalins (groupe 1) | |||||||||||||||||||||||||
| Hydrures alcalino-terreux (groupe 2) |
| ||||||||||||||||||||||||
| Hydrures du groupe 13 |
| ||||||||||||||||||||||||
| Hydrures du groupe 14 |
| ||||||||||||||||||||||||
| Hydrures de pnictogène (groupe 15) |
| ||||||||||||||||||||||||
| Chalcogénures d'hydrogène (groupe 16) |
| ||||||||||||||||||||||||
| Halogénures d'hydrogène (groupe 17) | |||||||||||||||||||||||||
| Hydrures de métal de transition |
| ||||||||||||||||||||||||
| Hydrures de lanthanide |
| ||||||||||||||||||||||||
| Hydrures d'actinide |
| ||||||||||||||||||||||||
| Exotiques |
| ||||||||||||||||||||||||
 Portail de la chimie
Portail de la chimie









