Loi de Dulong et Petit
En thermodynamique, la loi de Dulong et Petit est une loi empirique selon laquelle « la capacité thermique isobare molaire des éléments solides est voisine de », soit 25 J K‑1 mol−1. Pour la plupart des éléments elle est assez bien vérifiée à température ambiante.
Une règle empirique approximative
En 1819 Pierre Louis Dulong et Alexis Thérèse Petit[1] mesurent la capacité thermique massique de divers éléments chimiques solides. Les 13 éléments étudiés (S, Fe, Co, Ni, Cu, Zn, Ag, Sn, Te[Note 1], Pt, Au, Pb, Bi) ont une masse molaire comprise entre 32 et 209 g/mol. Leurs résultats montrent que le produit est indépendant de l'élément considéré[Note 2] et qu'il est égal à 25 J K‑1 mol−1 (à ± 1 J K‑1 mol‑1 près environ). En divisant ce résultat par la constante universelle des gaz parfaits = 8,314 J K‑1 mol‑1 et en remplaçant par , capacité calorifique molaire, on en déduit ce qui constitue la loi de Dulong et Petit.
Pour les valeurs de des éléments stables à 298 K (25 °C) voir le lien capacité calorifique. L'indice signifie que les valeurs sont mesurées à pression constante.
Pour les éléments solides[Note 3] on observe que :
- pour la grande majorité des éléments la loi de Dulong et Petit est vérifiée à ± 0,2 près, soit 23 J K−1 mol−1 < < 27 J K−1 mol−1 environ. Des déviations positives un peu plus élevées sont observées pour quelques métaux alcalins et alcalino-terreux, des terres rares et des actinides ;
- pour le gadolinium (Gd) atteint 4,45 ;
- pour 4 éléments (tableau ci-dessous), dont 3 sont des éléments légers, la valeur de est inférieure à 3R.
| Élément | Be | B | C (graphite) | C (diamant) | Si |
|---|---|---|---|---|---|
| 1,97 | 1,34 | 1,02 | 0,74 | 2,41 |
Intérêt historique
Les masses molaires des éléments qui sont gazeux ou qui forment des composés gazeux ont pu être déterminées à l'aide de la loi d'Avogadro[Note 4].
Les métaux et leurs combinaisons sont généralement solides, ce qui ne permet pas d'utiliser cette loi[2]. La composition massique d'un composé solide ne donne sa masse molaire qu'à un facteur près. Ainsi, dans la première version du tableau de Mendeleïev en 1869[3], trois éléments (Ce, In et U) ont été mal placés à cause d'une masse molaire inexacte. Dans le cas de l'oxyde d'uranium le pourcentage en masse de l'oxygène est égal à 11,85 %. À l'époque, la formule supposée de cet oxyde était UO d'où l'on déduit facilement pour l'uranium = 118 g/mol. Or, la valeur de sa capacité calorifique massique est = 0,116 J K‑1 g‑1 ce qui donnerait = 13,7 J K‑1 mol‑1 = 1,65 , valeur en désaccord avec la loi de Dulong et Petit. Par contre, si l'oxyde a pour formule UO2 alors = 238 g/mol et = 3,3 .
Mendeleïev s'est par la suite appuyé sur les déterminations de cp pour corriger les valeurs de M de ces trois éléments et les repositionner correctement[4]. L'extension de la loi de Dulong et Petit aux composés chimiques solides est connue sous le nom de loi de Kopp.
Un modèle moléculaire commun aux gaz et aux solides
On montre en théorie cinétique des gaz que l'énergie d'agitation thermique d'une mole de gaz monoatomique est égale . Le facteur 3 correspond aux trois coordonnées — ou degrés de liberté — nécessaires pour déterminer la position de chaque atome. La capacité calorifique à volume constant est donc égale à .
Dans un cristal, chaque atome de masse vibre autour de sa position d'équilibre O, sans toutefois la quitter. Son écart par rapport à O est également repérable par 3 coordonnées et son mouvement est celui d'un oscillateur harmonique tridimensionnel. L'énergie moyenne d'un oscillateur harmonique unidimensionnel — ou à un seul degré de liberté — est également partagée entre énergie cinétique et énergie potentielle. En admettant que l'énergie cinétique soit encore égale à son énergie totale devient égale à , soit encore à pour un oscillateur tridimensionnel. En dérivant on en déduit alors une capacité calorifique à volume constant égale à [Note 5]. On retrouve la loi de Dulong et Petit si l'écart entre et est négligeable.
Le modèle d'Einstein
Le modèle précédent ignore la quantification des valeurs de l'énergie de vibration et prévoit que la capacité calorifique est indépendante de , ce qui n'est pas le cas. Le modèle d'Einstein tient compte de la quantification de l'énergie.
De façon générale les valeurs de l'énergie d'un atome (niveaux d'énergie) sont quantifiées (discontinues) et peuvent donc être numérotées . À la température 0 K tous les atomes possèdent la plus basse énergie possible . À la température les atomes se répartissent sur les différents niveaux.

Le nombre d'atomes d'énergie constitue la population du niveau . Pour des niveaux simples le rapport des populations de deux niveaux numérotés et est donné par la loi de distribution de Boltzmann avec .
Dans cette relation le numérateur représente l'écart entre deux niveaux que l'on mesure le plus souvent par spectroscopie. Le dénominateur représente une énergie moyenne d'agitation thermique à l'échelle moléculaire.
Dans le cas d'un oscillateur harmonique quantique, les niveaux sont équidistants. Par conséquent, si l'on prend , alors où est le nombre quantique de vibration. On pose , où est la fréquence de la transition du niveau au niveau et est la constante de Planck. Le modèle de l'oscillateur harmonique représente les vibrations des molécules diatomiques avec une précision satisfaisante.
Le rapport entre l'espacement des niveaux et l'énergie d'agitation thermique est noté avec . La relation de Boltzmann ci-dessus s'écrit .
Deux cas limites sont à considérer :
- si alors est égal à 1 pour et nul pour : le niveau fondamental est le seul peuplé ;
- si alors décroît lentement en fonction de et il y a un grand nombre de niveaux peuplés.
Pour aller plus loin, il faut calculer le nombre de particules sur chaque niveau[5]. En écrivant que la somme des populations est égale à pour 1 mol, on obtient après calcul .
L'énergie d'agitation thermique est la somme des énergies des particules d'où l'on déduit après calcul :
La capacité calorifique de vibration s'en déduit par dérivation par rapport à d'où après calcul :
Les fonctions représentant et d'un oscillateur harmonique sont appelées 1re et 2e d'Einstein. On appelle température d'Einstein le rapport si bien que .
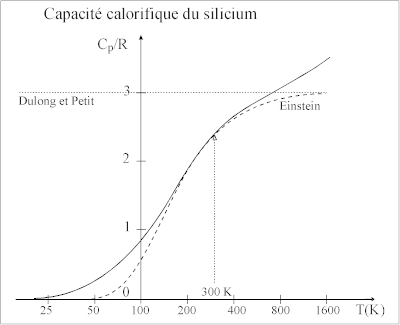
En reprenant les deux cas limite ci-dessus :
- si alors et : c'est ce qu'il se passe pour la plupart des molécules diatomiques gazeuses ;
- si alors et comme on le montre facilement après développement limité de .
Les atomes d'un solide monoatomique vibrent dans les 3 directions de l'espace donc avec 3 degrés de liberté, et par conséquent .
Pour la plupart des éléments solides, et en particulier les métaux courants, la valeur de ne dépasse guère 300 K. Dans ce cas particulier et on calcule = 0,92 d'où 2,76 . C'est pourquoi, lorsque est inférieure à la température ambiante, ce qui est le plus souvent le cas, la loi de Dulong et Petit est approximativement vérifiée.
Si et sont respectivement la masse et la constante de la force de rappel de l'atome, considéré comme un oscillateur harmonique, alors sa fréquence de vibration est donnée par :
La température d'Einstein est proportionnelle à donc à . On trouve donc des valeurs élevées de lorsque le rapport est grand. Les 4 éléments (Be, B, C, Si) pour lesquels est très inférieur à sont des éléments légers et durs (forte valeur de ). Les valeurs de augmentent avec et peuvent dépasser largement [6].
En réalité les vibrations des atomes ne sont pas localisées sur chaque atome mais sont sous forme d'ondes appelées phonons. C'est pourquoi le modèle d'Einstein est grossier et a été remplacé par le modèle de Debye qui donne cependant la même valeur limite de à haute température.
Les autres contributions à la capacité calorifique
Contribution de Cp - CV
Le modèle d'Einstein prévoit que la capacité calorifique a pour borne supérieure 3R. Mais en fait c'est que l'on mesure et il dépasse souvent 3R. En thermodynamique, la relation de Mayer générale permet de montrer que est toujours supérieur à et que l'écart est donnée par :
Par conséquent est toujours supérieur à . Dans cette relation et sont respectivement les coefficients de dilatation isobare et de compressibilité isotherme.
Par exemple pour le fer à 298 K :
- = 25,1 J K−1 mol−1 ou 3,02 ,
- = 3,54 × 10−5 K−1,
- = 7,12 × 10−6 m3,
- = 0,59 × 10−11 Pa−1.
On en déduit que = 0,44 J K−1 mol−1 ou 0,05 , d'où = 2,97 .
De fait dépasse rarement 0,1 à quelques exceptions près comme le césium :
- = 32,2 J K−1 mol−1 ou 3,87 ,
- = 2,91 × 10−4 K−1,
- = 68,6 × 10−4 m3,
- = 0,5 × 10−9 Pa−1,
d'où = 3,47 J K−1 mol−1 ou 0,42 et = 3,45 .
Capacité calorifique électronique
En thermodynamique statistique, on montre que les électrons des métaux contribuent assez peu à la capacité calorifique et on la néglige donc dans le modèle d'Einstein.

En fait, cette contribution est donnée par :
La constante dépend du métal et elle est le plus souvent de l'ordre de 10−3 à 10−2 J.K−1.mol−2. Pour Fe[6] par exemple 5 × 10−3 J K−2 mol−1 d'où 1,5 J K−1 mol−1 à 298 K ou encore 0,18R, ce qui représente 6 % du total selon la loi de Dulong et Petit.
Anharmonicité des vibrations
L'anharmonicité des vibrations de grande amplitude et l'apparition de lacunes contribuent aussi à la capacité calorifique en particulier près de la température de fusion[Note 6].
Transition ferromagnétique
Les métaux ferromagnétiques deviennent paramagnétiques au-dessus de leur température de Curie . La capacité calorifique de ces métaux en fonction de la température augmente progressivement lorsqu'on s'approche de pour redescendre rapidement ensuite. Ainsi, = 299 K pour le gadolinium Gd et = 4,45 R à 298 K. Dans le cas du fer, le ferromagnétisme disparaît à = 1043 K. Dans cette zone on observe un pic de croissance de qui dépasse 10R. Il s'agit d'une transition du second ordre[7]. Par contre, à 1185 K le changement de phase (allotropie) est une transition du premier ordre qui se manifeste par une cassure dans la variation de .
Les capacités calorifiques à basse température

À basse température, de l'ordre de quelques kelvins, on se trouve à l'opposé du domaine d'application de la loi de Dulong et Petit. Le modèle de Debye donne la variation correcte de la capacité calorifique qui, compte tenu de la contribution électronique et du fait que , s'écrit .
De cette formule, on déduit . Par conséquent, en portant en fonction de , on doit obtenir une droite de pente et d'ordonnée à l'origine .
La figure montre que pour le fer[6] = 4,9 × 10−3 J K−2 mol−1.
Notes et références
Notes
- ↑ La mesure de Dulong et Petit est trop faible d'un facteur 2 mais curieusement, pour la loi, en accord avec une masse molaire également trop faible du même facteur 2 à cause de l'oxyde TeO2 supposé être TeO. En 1835 Berzélius a noté cette erreur et donné la masse molaire correcte.Théorie des proportions chimiques, p. 106.
- ↑ Dulong et Petit ont obtenu pour ce produit, exprimé avec unité la calorie et avec l'oxygène pour base des masses molaires des atomes, une valeur moyenne de 0,375 ± 0,1 . En unités modernes il vaut donc mcp = 0,375x16x4,184 = 25,1 ≈ 25.
- ↑ Dans la suite on considère des exemples d’éléments solides métalliques (Fe) ou covalents (Si) mais la loi de Dulong et Petit est également observée pour les quelques éléments moléculaires comme I2 ou S8.
- ↑ La loi d'Avogadro s'applique à tous les gaz sous basse pression et elle est justifiée par la théorie cinétique des gaz. Au contraire, la "loi" de Dulong et Petit est une règle empirique, comme la règle de Trouton. L'interprétation détaillée de la capacité calorifique montre qu'elle ne peut être vérifiée qu'à une seule température qui dépend de l'élément considéré.
- ↑ C'est pourquoi à 298 K du fer solide (2,96R) est à peu près le double de de l'argon, gaz monoatomique, (1,50R).
- ↑ À la température de fusion d'un élément solide, en général < < , ce qui est évidemment très supérieur aux de la loi de Dulong et Petit.
Références
- ↑ A. T. Petit et P. L. Dulong, Recherches sur quelques points importants de la théorie de la chaleur, dans Annales de chimie et de physique, vol. 10, 1819, p. 395–413.gallica
- ↑ M. Loing et M. Loing, J. Chem. Educ, 2006, 83, p. 1499-1504.
- ↑ D. Mendeleïev, Z. Prakt. Chem. 1869, 106 (4), 251.
- ↑ D. Mendeleïev, Le système naturel des éléments, application à la prédiction des propriétés d'éléments encore non découverts, Zhur. Russ. Khim. Obsh., 1871, 3 (2), 25-56.
- ↑ Adolphe Pacault, Éléments de thermodynamique statistique., Paris, Masson, (OCLC 299912410), p. 77 et 110.
- ↑ a b et c Thermodynamic Properties of Iron and Silicon P.D. Desai, J. Phys. Chem. Ref. Data, 1986, 15, p. 967-983.
- ↑ E A Guggenheim (trad. J.C. Doukhan), Thermodynamique ... Thermodynamics., Paris, Dunod, (OCLC 25191867), p. 302-312.
 Portail de la physique
Portail de la physique  Portail de la chimie
Portail de la chimie










































































































