Aluminiumiodid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
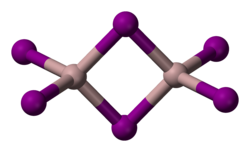 | ||||||||||||||||
| _ Al3+ 0 _ I− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Aluminiumiodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | AlI3 | |||||||||||||||
| Kurzbeschreibung | weißes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 407,70 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 3,98 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | 191 °C[1] | |||||||||||||||
| Siedepunkt | 360 °C[1] | |||||||||||||||
| Dampfdruck | 1 hPa (178 °C)[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | −302,9 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Aluminiumiodid ist eine chemische Verbindung aus der Gruppe der Iodide.
Gewinnung und Darstellung
Aluminiumiodid kann durch Reaktion von Aluminium mit Iod gewonnen werden.[5]
Eigenschaften

Aluminiumiodid ist ein weißes Pulver,[1] das aus farblosen Blättchen besteht. Es ist feuchtigkeitsempfindlich und zersetzt sich beim Erhitzen an der Luft unter Bildung von Iod und Aluminiumoxid.[5] Es kristallisiert in einer monoklinen Struktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14)Vorlage:Raumgruppe/14, a = 9,591 Å, b = 6,069 Å, c = 11.902 Å, β = 108,05°[6], in der es als Dimer Al2I6 vorliegt.[7][8]
Verwendung
Aluminiumiodid wird bei organischen Synthesen als Katalysator zum Aufbrechen von bestimmten Arten von C–O- und N–O-Bindungen verwendet. Es spaltet Arylether und zersetzt Epoxide.[9] Es kann auch zur Herstellung von iodierten organischen Verbindungen verwendet werden.[10]
Weblinks
Einzelnachweise
- ↑ a b c d e f g Datenblatt Aluminum iodide, anhydrous, powder, 99,999 % trace metals basis bei Sigma-Aldrich, abgerufen am 12. Februar 2012 (PDF).
- ↑ a b Physical constants of inorganic compounds. In: CRC Handbook of Chemistry and Physics. 88th edition, CRC Press, Boca Raton, FL 2007–2008, S. 4–43.
- ↑ a b Eintrag zu Aluminiumiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-5.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 876.
- ↑ S.I. Troyanov, T. Krahl, E. Kemnitz: Crystal structures of GaX3 (X=Cl, Br, I) and AlI3. In: Zeitschrift für Kristallographie. Band 219, Nr. 2, 2004, S. 88–92, doi:10.1524/zkri.219.2.88.26320.
- ↑ John C. Bailar: Inorganic Syntheses. 1953, S. 118 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ John C. Kotz, Paul Treichel, Gabriela C. Weaver: Chemistry & chemical reactivity. 2005, ISBN 978-0-534-99766-3, S. 1038 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ M. Gugelchuk: Aluminum Iodide. In: L. Paquette (Ed.): Encyclopedia of Reagents for Organic Synthesis. J. Wiley & Sons, New York 2004, doi:10.1002/047084289X.ra083.
- ↑ Sung Lee, Geum-Sook Hwang, Do Ryu: Aluminum Iodide Promoted Highly Z-Stereoselective Synthesis of β-Iodo Morita-Baylis-Hillman Esters with Ketones as Aldol Acceptors. In: Synlett. Band 2007, Nr. 1, 2007, S. 59–62, doi:10.1055/s-2006-958421.







